Om te weten waarom ureum, zout en suiker goed in water oplossen, moet je iets weten van de elektrische ladingsverdeling in een watermolecuul en andere moleculen.
Stoffen die goed in water kunnen oplossen heten polaire stoffen of hydrofiele stoffen (hydro = water, fiel = houden van). Stoffen die slecht in water oplossen zijn apolair, hydrofoob of lipofiel (drie woorden voor hetzelfde begrip; foob = afkeer of angst hebben van, lipo = vetachtig).
Opdracht (W14) proef (in groepjes van twee)
Maak van te voren een werkplan (zie werkblad)
Het werkplan zal in dit geval het schema zijn dat in het werkblad staat. Bedenk dat het geen verschil maakt of je hexaan toevoegt aan water, of juist water aan hexaan.
Ga na of de volgende vloeistoffen met elkaar mengen:
- water
- alcohol (ethanol, CH3-CH2-OH)
- benzine of hexaan (C6H14)
- slaolie of paraffine (C12H26)
Kijk vervolgens in welke van bovenstaande vloeistoffen de vaste stoffen ureum en jood (I2) kunnen oplossen.
Werk met schone, droge reageerbuizen. Doe van de eerste vloeistof ongeveer 2 cm in een reageerbuis. Voeg hier (met een druppelpipet) ongeveer 2 cm van de andere vloeistof toe. Als er een scheidingsvlak is, geef je dit aan met een viltstift. Vervolgens schud je de reageerbuis en kijkt of het scheidingsvlak op dezelfde plaats is gebleven. Is het niet verschoven, dan mengen de beide vloeistoffen niet. Is het verschoven, dan mengen de beide vloeistoffen matig. Is er geen scheidingsvlak, dan mengen beide vloeistoffen goed.
Voeg van de vaste stoffen een mespuntje toe aan 3 cm vloeistof in een reageerbuis. Schud goed (niet met je duim op de buis!) en kijk of de vaste stof oplost.
- Verwerk de resultaten in een overzichtelijke tabel. Geef daarin aan of de stof polair of apolair is.
- Wat is je conclusie?
Als een stof in een andere stof kan oplossen, dan betekent dit dat er een bepaalde aantrekkingskracht is tussen de moleculen van de ene stof en die van de andere stof. Dit soort aantrekkingskrachten heeft altijd met elektrische lading in en tussen moleculen te maken.
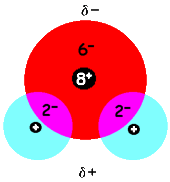 In een watermolecuul zit tussen een waterstofatoom en het zuurstofatoom een gemeenschappelijk elektronenpaar. Dit elektronenpaar is niet "eerlijk" verdeeld. Een zuurstofatoom zit hier harder aan te "trekken" dan het waterstofatoom. In binas tabel 39 staat het begrip elektronegativiteit. Hoe groter de elektronegativiteit, des te harder "trekt" een atoom aan een gemeenschappelijk elektronenpaar.
In een watermolecuul zit tussen een waterstofatoom en het zuurstofatoom een gemeenschappelijk elektronenpaar. Dit elektronenpaar is niet "eerlijk" verdeeld. Een zuurstofatoom zit hier harder aan te "trekken" dan het waterstofatoom. In binas tabel 39 staat het begrip elektronegativiteit. Hoe groter de elektronegativiteit, des te harder "trekt" een atoom aan een gemeenschappelijk elektronenpaar.
In binas tabel 39 staat dat een zuurstofatoom een elektronegativiteit heeft van 3,5 en waterstof een elektronegativiteit van 2,1. Een watermolecuul is daardoor aan de kant van zuurstof een beetje negatief (aangegeven met d–; d is de Griekse kleine letter delta). Aan de kant van de waterstofatomen is een watermolecuul een klein beetje positief (aangegeven met d+). Een watermolecuul heeft daardoor twee polen, een plus- en een minpool. Een molecuul met twee polen heet een dipool ofdipoolmolecuul.
In BINAS tabel 54 staan de zogenaamde dipoolmomenten van moleculen. Het dipoolmoment is het product van het ladingsverschil en de afstand. Hoe groter het dipoolomoment, hoe sterker de dipool. Een dipoolmoment nul wil zeggen dat het molecuul geen dipool is.
In een dipoolmolecuul zitten de elektronen van een gemeenschappelijk elektronenpaar het dichtst bij het atoom met de grootste elektronegativiteit en is er sprake van een polaire atoombinding.
Opdracht (W15) werkblad
Verklaar welke van de volgende stoffen sprake is van een dipoolmolecuul; geef bij deze moleculen aan welke kant d– en welke kant d+ is. Gebruik in je uitleg zo nodig zowel een structuurformule als een tekening van het molecuul.
- waterstofbromide (HBr)
- zuurstof (O2)
- stikstofmonoxide (NO)
- ammoniak (NH3). De drie H-atomen in een NH3-molecuul vormen een "driepootje" met stikstof daar bovenop.
- koolstofdioxide (kooldioxide, CO2). De drie atomen liggen op een rijtje, met koolstof in het midden.
Vergelijk je antwoord met de dipoolmomenten die in binas tabel 54 staan.
Bedenk welke informatie (illustraties, stukken tekst) je kunt gebruiken voor de folder. Zet deze informatie vast weg op een diskette of op de harde schijf.
