We weten dat water de formule H2O heeft, maar we weten nog niet waarom de waterstofatomen aan het zuurstofatoom vast blijven zitten. Als je kijkt naar de ladingen van de kernen en de elektronenwolken, ziet een watermolecuul er ongeveer als volgt uit:
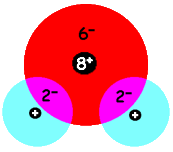
Je ziet dat er tussen de positief geladen kernen extra negatieve lading zit van de elektronenwolken. Tussen de kern van het zuurstofatoom en de kern van een waterstofatoom zit een gemeenschappelijk elektronenpaar. Dit soort binding heet een covalente binding of atoombinding.
Van de acht elektronen van een zuurstofatoom doen er twee mee met een binding. Het zuurstofatoom met de overgebleven zes elektronen heet een atoomrest. Een atoomrest is altijd positief, het negatieve gemeenschappelijke elektronepaar houdt de atoomresten bij elkaar.
Opdracht (W11) werkblad
Ureum is een afvalstof die vrijkomt bij de vertering van eiwitten en via de nieren je lichaam verlaat. Het is een witte, vaste stof met de formule CH4N2O. Als je ureum verhit in een reageerbuis, blijft er een vaste, zwarte stof over; de eigenschappen van de stof veranderen. (Iets dergelijks gebeurt als je suiker verhit.)
- Hoe heet ontleding door verhitting?
- Wat gebeurt er in dit geval met de atomen in de ureummoleculen?
- Wat zal de zwarte stof waarschijnlijk zijn?
Ureum is goed oplosbaar bloed en urine, dus in water.
- Wat gebeurt er met de atomen in een ureummolecuul als je de vaste stof oplost in water?
Een molecuul waterstofchloride ziet er ongeveer als volgt uit:
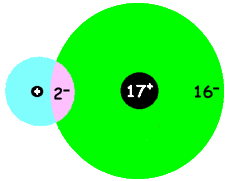
Omdat het lastig is steeds steeds van deze tekeningen te maken, werken chemici met formules. Je gaat dan van de nanososcopische wereld naar desymbolische wereld. De afspraak is dat je de atoomsoorten met het juiste symbool aanduidt en dat je voor elk gemeenschappelijk elektronenpaar één streepje zet. Water en waterstofchloride zien er dan als volgt uit: ![]()
Dit soort formules heet structuurformules. Ze geven min of meer aan wat de structuur is van een molecuul.
Opdracht (W12) werkblad
- Teken een model van H2S op dezelfde manier als hierboven het model van HCl is getekend.
- Waaruit bestaat de atoomrest van S in een H2S-molecuul?
Het aantal bindingen dat een bepaald atoomsoort kan vormen is de covalentie van dat atoom. Een overzicht hoeveel bindingen elk atoomsoort kan hebben staat hieronder.
Atoomsoort | Formule | Covalentie |
|---|---|---|
waterstof | H | 1 |
fluor | F | 1 |
chloor | Cl | 1 |
broom | Br | 1 |
jood | I | 1 |
zuurstof | O | 2 |
zwavel | S | 2 (soms 6) |
stikstof | N | 3 |
fosfor | O | 3 (soms 5) |
koolstof | C | 4 |
Opdracht (W13) werkblad
De stof waterstoffluoride is opgebouwd uit moleculen HF. Tussen de atomen van waterstof en fluor zit een atoombinding.
- Hoeveel elektronen heeft een atoom fluor?
- Hoeveel elektronen heeft een waterstofatoom beschikbaar voor een binding?
- Teken de structuurformule van HF.
- Leg uit hoeveel atoombindingen broom- en joodatomen kunnen vormen met waterstofatomen.
Huishoudammonia is een oplossing van het gas ammoniak in water. De formule van ammoniak is NH3.
- Wat is het atoomnummer van stikstof?
- Leidt uit de formule NH3 af hoeveel elektronen het stikstofatoom gebruikt voor gemeenschappelijke elektronenparen.
- Teken de structuurformule van ammoniak.
Geef de formule van het molecuul dat is opgebouwd uit:
- H- en S-ato(o)m(en) (S vormt hierbij twee bindingen)
- C- en O-ato(o)m(en)
- N- en F-ato(o)m(en)
- C- en Br-ato(o)m(en)
- O- en H-ato(o)m(en)
